实验室副主任李新钢教授和细胞与神经功能测试平台陈安静研究员团队在蛋白折叠领域取得新进展
2024年4月,济南微生态生物医学省实验室李新钢教授、陈安静研究员团队,在《Cancer Letters》杂志发表题为“Targeting the molecular chaperone CCT2 inhibits GBM progression by influencing KRAS stability ” 的研究成果。本研究针对胶质母细胞瘤(GBM)恶性程度高、预后差、治疗效果不理想的难题,致力于寻找并靶向导致GBM发生、发展的关键蛋白质,作为GBM治疗的潜在策略。
蛋白质折叠(Protein folding)需要分子伴侣(Molecular chaperone)的协助,研究关键致癌基因的分子伴侣对理解癌症发生和演化机制,寻找新抗癌治疗靶点具有重要的科学和临床应用意义。
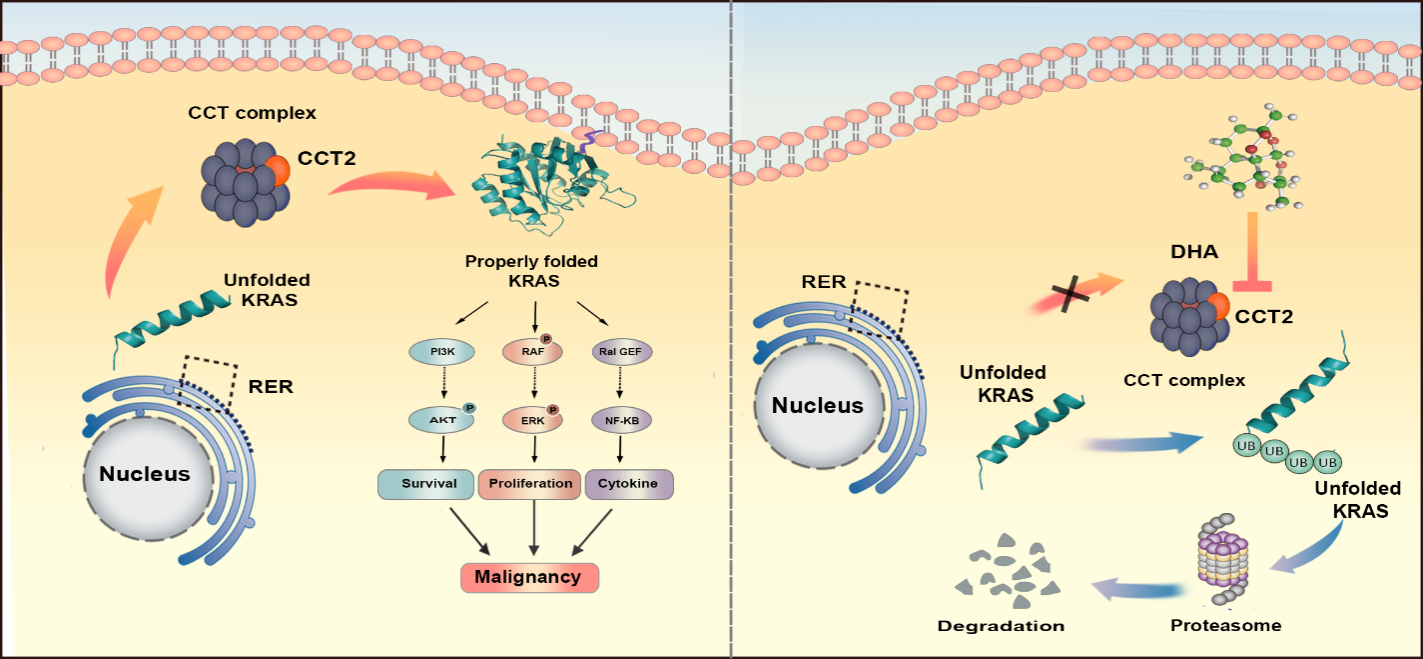
本研究在GBM中鉴定到了一个高表达的分子伴侣—— CCT2(含有 TCP1 复合物的伴侣蛋白亚基2),CCT2的高表达与GBM的不良预后相关,是一个潜在的促癌基因。
本研究通过细胞实验以及利用裸鼠原位异种移植模型,证明了CCT2可以在体外及体内促进GBM的恶性增殖与侵袭性生长,并利用免疫沉淀(IP)、液相色谱-质谱(LC-MS)和表面等离子体共振(SPR)等技术找到了能与CCT2直接结合的下游分子—— KRAS (Kirsten大鼠肉瘤病毒癌基因同源物),明确了CCT2促癌的机制。
KRAS是RAS基因的一员,在多种肿瘤中发生突变,导致下游信号持续激活,是肿瘤发生的重要因素。由于KRAS分子量小和构型圆滑的特点,导致小分子抑制剂难以靶向KRAS,KRAS一直以来都是“不可成药”的代名词。
团队的研究证明了 CCT2 可增强 KRAS 下游的信号传导,并促进 GBM 的恶性进展。其促癌作用是通过与 KRAS 直接结合来调节 KRAS 的稳定性实现的。
同时团队还发现了双氢青蒿素(DHA),一种治疗疟疾的一线用药,可以发挥GBM治疗作用。DHA 通过直接结合和抑制 CCT2,从而抑制 KRAS 下游的信号传导来发挥抗 GBM 作用。CCT2 是折叠和稳定 KRAS 的上游分子,DHA 以 CCT2 为靶点,规避了 KRAS 不可药用的科学难题。DHA有望成为一种治疗胶质瘤的靶向药物。
山东大学齐鲁医院研究生赵飞虎为第一作者,济南微生态生物医学省实验室细胞与神经功能测试平台陈安静研究员和李新钢教授为共同通讯作者。该项目得到了泰山学者专项基金项目(tsqn201909173、ts20110814和tshw201502056),山东省科技厅重大基础研究(ZR2022ZD36),山东省科技厅省实验室项目(SYS202202)和济南微生态生物医药省实验室(JNL-2023007C、JNL-2022003A)等基金支持。