济南实验室顾晓松院士、江春平教授及曹毅教授团队在《PNAS》上发表《结构和机械性能可调的大孔水凝胶用于大规模生产间充质干细胞-细胞外基质球体》
近期,济南实验室顾晓松院士、实验室副主任江春平教授及曹毅教授团队在《PNAS》(IF:9.4)发表题为“Structurally and mechanically tuned macroporous hydrogels for scalable production of mesenchymal stem cell-extracellular matrix spheroids”的研究性论文。研究团队设计了一种骨髓启发的大孔水凝胶,可以有效地扩增间充质干细胞并生成MSC-ECM球体。
在再生医学领域,间充质干细胞(MSCs)因其广泛的细胞来源、高分化潜力、免疫调节和组织再生能力,展现出巨大的应用前景。然而,现有的扩增方法常常无法维持关键的细胞外基质(ECM)成分,这对其治疗效果至关重要。针对这一问题,本研究团队设计了一种骨髓启发的大孔水凝胶,用于大规模扩增间充质干细胞并生成MSC-ECM球体。这种新型水凝胶通过液-液相分离的软模板方法制备,具备可调的孔径、硬度、生物活性配体分布和酶响应性降解性,为MSC的优化增殖和收获提供了理想的环境。
大孔水凝胶的设计和表征
大孔水凝胶的核心设计基于聚乙二醇(PEG)和右旋糖酐的液-液相分离。通过选择适当的PEG和右旋糖酐浓度以及合适的静置时间,形成具有理想孔径的水凝胶。PEG相通过紫外光触发的加成反应交联形成水凝胶,而右旋糖酐相作为软模板,在水凝胶完全膨胀后被移除。最终形成的水凝胶具有与骨髓相似的多孔结构和机械性能。在显微镜和扫描电镜下观察到,水凝胶的孔径约为200至600微米,机械性能测试表明其杨氏模量约为880帕斯卡,具备良好的弹性。此外,水凝胶在TEV蛋白酶存在下可以迅速降解,实现MSC的高效收获。
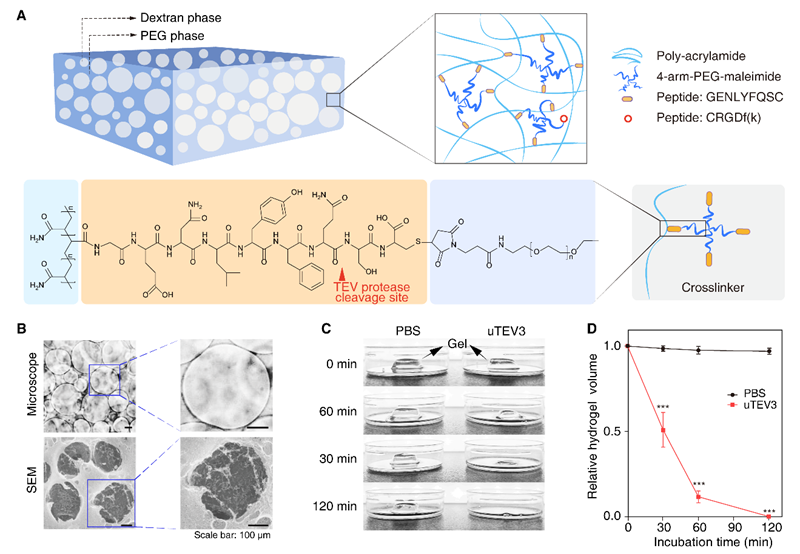
图1 可快速降解的大孔水凝胶的设计和特性。(A) 大孔水凝胶的示意图。水凝胶的多孔结构基于混合PEG和右旋糖酐的液-液相分离形成。四臂PEG-马来酰亚胺的末端通过马来酰亚胺与半胱氨酸残基硫醇侧链之间的迈克尔加成反应与丙烯酸酯-GENLYFQSC(作为TEV蛋白酶底物)共价连接,得到的功能化PEG用作交联剂。水凝胶通过丙烯酸酯和丙烯酰胺之间的紫外线触发加成反应形成。作为软模板的右旋糖酐相在水凝胶完全膨胀后浸泡在细胞培养基或PBS中去除。(B) 大孔水凝胶的光学和扫描电镜图像。(比例尺为100 μm)。(C) 水凝胶在PBS或300 μg/ml TEV蛋白酶(uTEV3)存在下在0-120分钟内的降解情况。(D) 在指示条件下水凝胶的相对体积(*** p < 0.001)。
在大孔水凝胶中MSC扩增的机械信号响应
为了探究不同硬度的大孔水凝胶对MSC增殖的影响,本研究团队进行了详细的实验分析。研究发现,在较软的水凝胶中,MSC倾向于扩散并保持球体形态,同时产生更多的牵引力,促进细胞迁移。而在较硬的水凝胶中,MSC的迁移受限,主要以球体形式存在。此外,水凝胶的柔软性增强了细胞的机械转导作用,有助于维持MSC的干性和增殖能力。通过免疫荧光染色和基因表达分析,本研究团队发现较软水凝胶中的MSC表现出更高的YAP核质比、更强的细胞外基质分泌能力和更高的增殖率。这些结果表明,水凝胶的刚度对MSC的生长形态和功能具有显著影响。
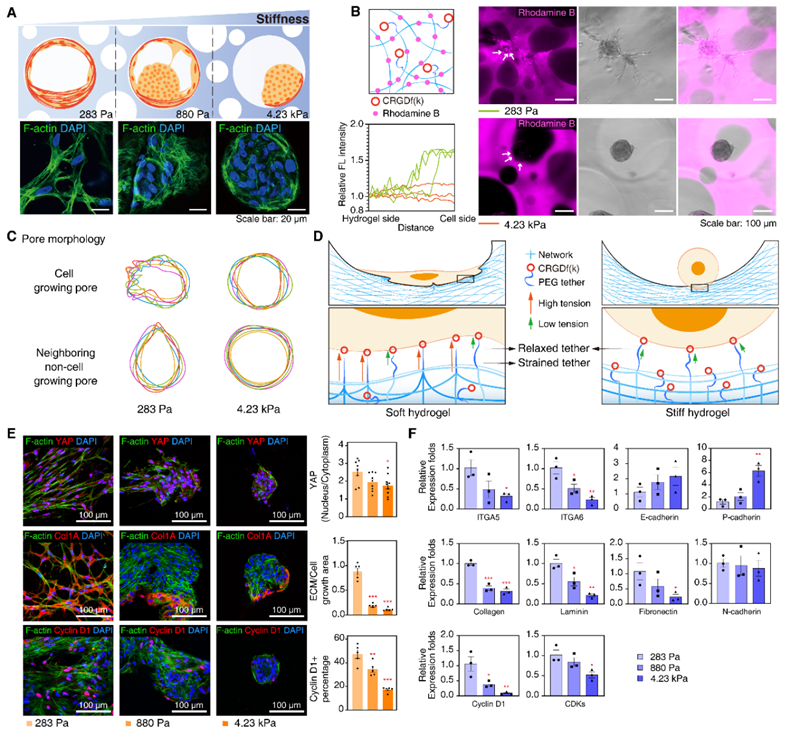
图2 MSC在大孔水凝胶中培养的机械信号。(A) 不同模量的大孔水凝胶中生长的MSC的示意图(上)和F-肌动蛋白的免疫荧光染色(下)。细胞核用DAPI染色。(B) 示意图说明罗丹明B在水凝胶网络中的共价锚定(左上)。在不同模量的罗丹明B耦合水凝胶中生长的MSC(右)。沿白色虚线箭头指示路径的荧光强度(左下)。(C) 在不同模量的水凝胶中有细胞生长的孔的形态轮廓和相邻无细胞生长的孔。(D) 大孔水凝胶中细胞的力分析示意图:在较软的水凝胶中,松散的水凝胶网络和PEG臂末端的RGD使MSC更容易在水凝胶内募集RGD。这导致产生更大的牵引力,促进MSC迁移。相反,在较硬的水凝胶中,MSC通常感知到的牵引力较小,从而限制MSC迁移。(E) 在不同模量的水凝胶中MSC的F-肌动蛋白(绿色荧光)和YAP(红色荧光)、Col1A(红色荧光)和Cyclin D1(红色荧光)的免疫荧光共染色(左)及相应的分析结果(右)。细胞核用DAPI染色(比例尺为100 μm)。(* p<0.05; ** p<0.01; **p<0.001) (F) 与MSC功能相关的基因的相对表达水平,包括细胞粘附(ITGA5、ITGA6、E-钙粘蛋白、P-钙粘蛋白和N-钙粘蛋白)、细胞外基质(胶原蛋白、层粘连蛋白和纤连蛋白)和细胞周期(Cyclin D1和CDKs)( p<0.05; ** p<0.01; ***p<0.001)。
长期扩增后MSC的功能评估
在大孔水凝胶中培养14天后,MSC表现出显著的增殖能力,细胞数量增加约100倍。活/死染色结果显示,水凝胶中的MSC在长时间培养过程中保持高活性,且无中心坏死现象。通过免疫荧光染色和RT-PCR分析,本研究团队确认了扩增的MSC在水凝胶中保持了高水平的干性标志物表达。此外,扩增的MSC在成骨和脂肪生成培养基中表现出良好的分化潜力,分别在成骨细胞和脂肪细胞中检测到高水平的Col1A、OCN和脂联蛋白表达。
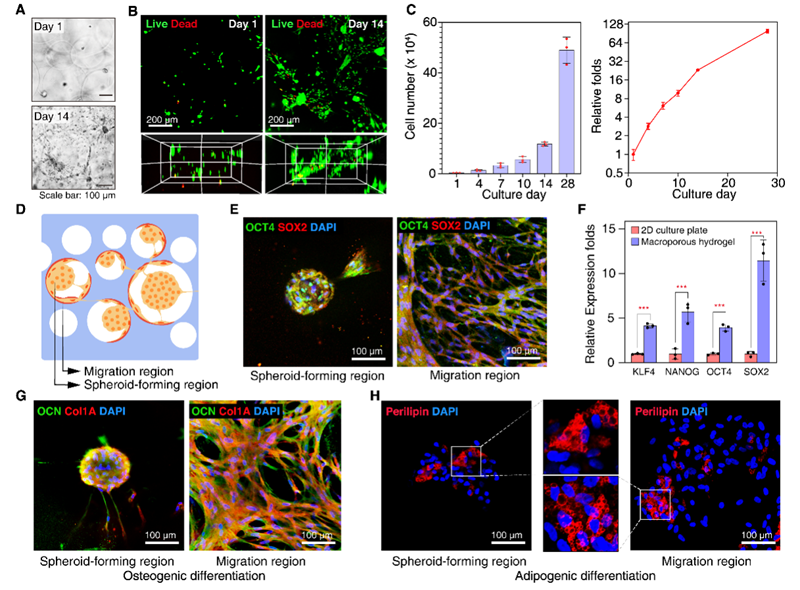
图3 扩增MSC的活力、扩增率和分化潜力评估。(A) 水凝胶中第1天和第14天的代表性显微镜照片(比例尺为100 μm)。(B) 水凝胶中第1天和第14天的MSC的活/死染色。绿色荧光表示活细胞,红色荧光表示死细胞。(比例尺为200 μm)(C) 28天培养期间MSC数量的定量。经过28天扩增,MSC扩增约100倍。(D) 大孔水凝胶中生长的MSC的示意图。水凝胶中的MSC表现出两种模式,划分出不同的区域:球体形成区和迁移区。(E) 球体形成区和迁移区的MSC中OCT4(绿色荧光)和SOX2(红色荧光)的免疫荧光共染色(左)。细胞核用DAPI染色(比例尺为100 μm)。(F) 在大孔水凝胶中培养的MSC的干性基因(KLF4、NANOG、OCT4和SOX2)的相对表达倍数。以常规2D培养板上培养的MSC作为对照。(***p<0.001)(G) 在成骨分化培养基中培养的球体形成区和迁移区的MSC衍生成骨细胞中OCN(绿色荧光)和Col1A(红色荧光)的免疫荧光共染色(中)。细胞核用DAPI染色(比例尺为100 μm)。(H) 在脂肪生成分化培养基中培养的球体形成区和迁移区的MSC衍生脂肪细胞中脂联蛋白(红色荧光)的免疫荧光染色(右)。细胞核用DAPI染色(比例尺为100 μm)。
通过酶降解收获MSC
为了实现MSC的温和收获,本研究团队采用TEV蛋白酶降解水凝胶的方法。降解过程中,MSC与分泌的细胞外基质蛋白快速结合,形成MSC-ECM球体。这些球体在降解后重新种植于培养板上,表现出良好的附着和迁移能力,并保持高水平的OCT4和主要ECM蛋白的表达。
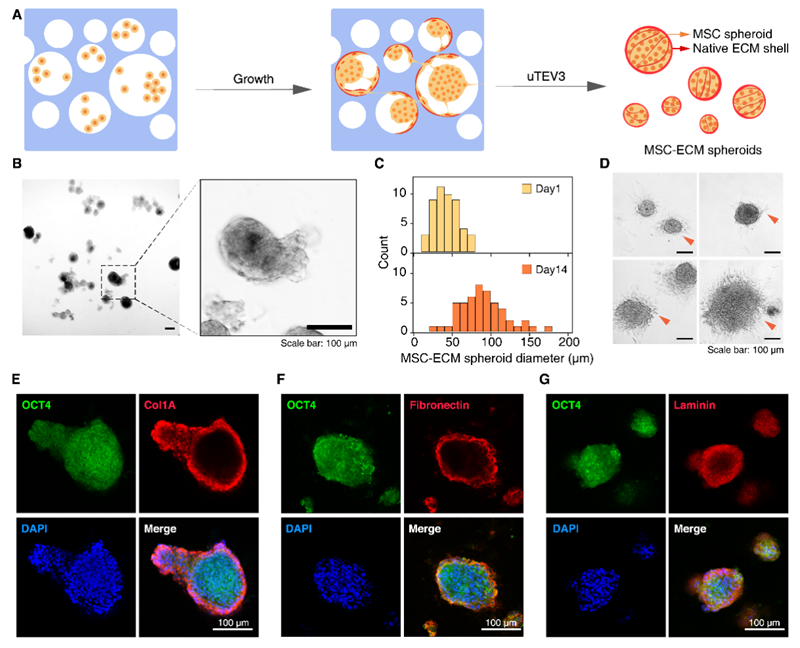
图4 TEV蛋白酶降解水凝胶以释放扩增的MSC形成MSC-ECM球体。(A) 从水凝胶中收获扩增的MSC的过程示意图。使用uTEV3降解水凝胶,导致MSC与分泌的细胞外基质蛋白分离。这些成分随后自组装形成MSC-ECM球体。(B) 水凝胶降解后漂浮在培养基中的MSC-ECM球体的光学图像。(比例尺为100 μm)(C) 第1天和第14天收获的MSC-ECM球体直径的统计分析。(D) 各种尺寸的收获MSC-ECM球体重新附着到培养板上,迁移细胞用箭头表示。(比例尺为100 μm)(E)-(G) OCT4和主要细胞外基质蛋白的免疫荧光共染色。OCT4用绿色表示,ECM蛋白(Col1A (E)、纤连蛋白 (F) 和层粘连蛋白 (G))分别用红色表示。细胞核用DAPI染成蓝色。(比例尺为100 μm)
收获的MSC-ECM球体的分化
对比研究表明,MSC-ECM球体在脂肪生成和成骨分化方面表现出显著增强的潜力。油红O染色显示,MSC-ECM衍生的MSC在脂肪生成方面的强度比常规培养板(TCP)衍生MSC增强了3-4倍。此外,MSC-ECM衍生的MSC在成骨分化9天后表现出大量矿化沉积,而TCP衍生的MSC在同一时间点尚未产生矿化沉积。
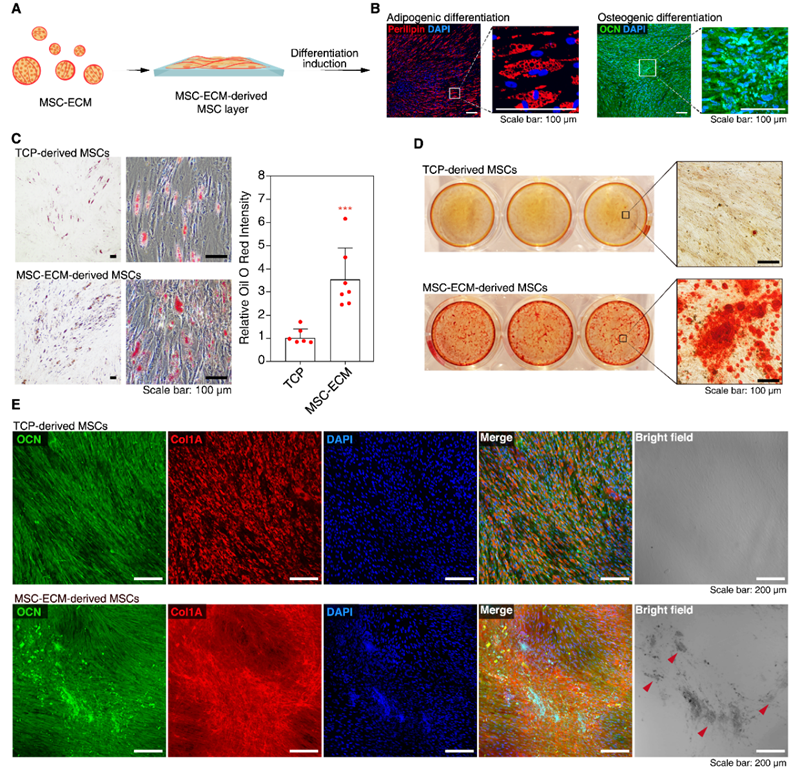
图5 MSC-ECM球体在脂肪生成和成骨分化方面显示出增强的潜力。(A) MSC-ECM球体重新种植到培养板进行脂肪生成和成骨分化的示意图。(B) MSC-ECM衍生的MSC显示出强大的脂肪生成分化能力,通过脂联蛋白的免疫荧光染色(左)和成骨细胞通过OCN的免疫荧光染色(右)表示。细胞核用DAPI染色。(比例尺为100 μm)(C) TCP衍生MSC和MSC-ECM衍生MSC的脂肪生成分化比较。脂滴的油红O染色显示,ECM-MSC衍生MSC的强度比TCP衍生MSC增强平均3-4倍。(比例尺为100 μm)(*** p < 0.001)(D) TCP衍生MSC和MSC-ECM衍生MSC成骨分化9天的比较。用茜素红S染色矿化沉积。MSC-ECM衍生MSC显示出大量矿化沉积点,而TCP衍生MSC在同一时间点尚未产生矿化沉积。(E) TCP衍生MSC和MSC-ECM衍生MSC在成骨分化过程中OCN(绿色)和Col1A(红色)的免疫荧光共染色。MSC-ECM衍生MSC产生的矿化沉积在亮场图像中用箭头表示。(比例尺为200 μm)
qPCR阵列分析MSC-ECM球体的基因表达
通过qPCR阵列分析,本研究团队发现MSC-ECM球体在干性、软骨发育、骨骼系统发育、炎症反应、血管生成和免疫反应相关基因的表达水平显著上调。这些结果表明,MSC-ECM球体在治疗某些疾病方面具有出色的潜力。
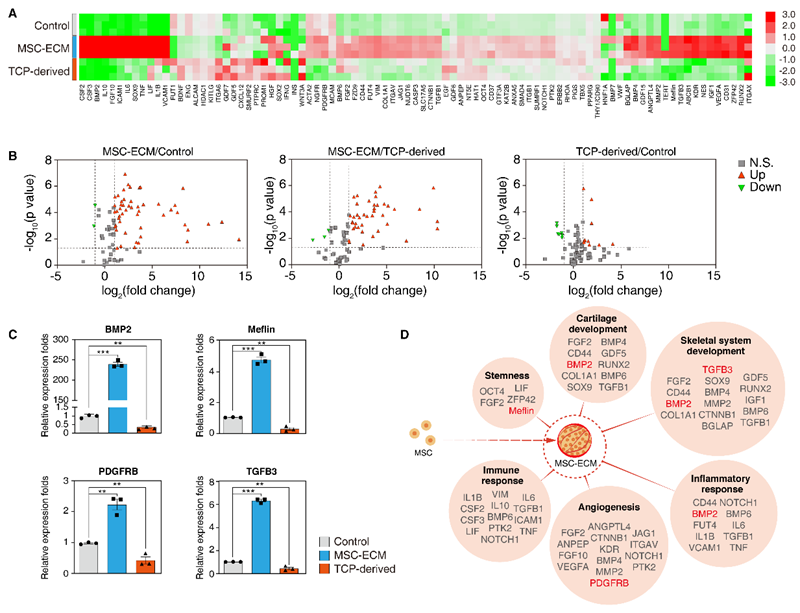
图6 qPCR阵列揭示对照组、MSC-ECM衍生MSC和TCP衍生MSC之间的基因表达差异及相应功能。(A) 对照组(上面板)、MSC-ECM(中间板)和TCP衍生MSC(下面板)中所有89个检测基因的转录水平热图显示。(B) 火山图识别各组间显著调控的基因(左,MSC-ECM/对照组;中,MSC-ECM/TCP衍生;右,TCP衍生/对照组)。显著上调超过2倍的基因用红色符号表示,显著下调超过2倍的基因用绿色符号表示。
总结
本团队的研究表明,通过设计结构和机械性能可调的大孔水凝胶,可以有效地扩增间充质干细胞并生成MSC-ECM球体。这种方法不仅提高了MSC的增殖率和分化潜力,还提供了一种温和的收获方式,保留了关键的细胞外基质成分。通过这种方式生产的MSC-ECM球体在组织再生、移植和干细胞治疗中的应用前景非常广阔。
本研究得到了山东省实验室项目(SYS202202)、国家自然科学基金(11934008、T2225016)、国家重点研发计划(2020YFA0908100、2023YFC3605802)、江苏省自然科学基金项目(BK20220120)、中央高校基本科研业务费(020514380274)、济南微生态生物医学省实验室研究项目(JNL2022004A)的资助。