实验室郑树森院士及王杭祥教授团队在《Nature Communications》期刊发表抗肿瘤免疫激活的无药物自组装体研究成果
近日,郑树森院士团队联合王杭祥教授团队在抗肿瘤免疫激活的无药物自组装体的研究方面取得最新进展,研究成果以“Mitochondrial Rewiring with Small-Molecule Drug-Free Nanoassemblies Unleashes Anticancer Immunity”为题,于2024年9月3日在《Nature Communications》(IF:14.3)杂志在线发表。基于人体所必须的脂肪酸结构衍生,本研究开发了一种无需药物的小分子自组装体(mtDSN),通过特异性靶向调控线粒体功能,诱导免疫原性细胞死亡(ICD)并增强抗肿瘤免疫应答。

免疫检查点阻断疗法(Immune checkpoint blockade, ICB)是抗肿瘤领域的革命性进展,在多种恶性肿瘤中表现出优越的临床疗效。然而,由于肿瘤T淋巴细胞浸润不足、高免疫抑制因子含量和低肿瘤突变的冷肿瘤效应导致该种治疗方案应答率较低。在临床上仅少部分患者对ICB治疗有免疫应答,许多部分免疫应答者最终由于肿瘤免疫逃避而导致疾病进展。应激和垂死的肿瘤细胞释放出大量的免疫刺激分子,包括肿瘤代谢物、肿瘤相关抗原和损伤相关模式分子(DAMPs)。这些生物活性成分与宿主免疫系统相互作用,激活适应性免疫反应以诱导抗肿瘤免疫反应。
研究表明,线粒体在炎症调节和增强肿瘤免疫原性中起重要作用,是与当前ICB免疫疗法协同的潜在靶点。例如,线粒体破坏后释放的线粒体DNA,除了作为损伤相关分子模式(DAMP),激活NLRP3炎性小体和Toll样受体TLR9诱导炎症反应外,还可激活干扰素基因刺激因子(STING)通路。此外,线粒体的生物发生、动力学和活性氧(ROS)的产生可调节肿瘤浸润免疫细胞的功能。
因此,选择性线粒体靶向和干预策略可以通过激发肿瘤细胞免疫原性,激活特异性效应T细胞并增强其在肿瘤中的浸润从而实现高效抗肿瘤。然而,开发能够促进肿瘤免疫原性的治疗策略,增加对ICB治疗的反应,同时最小化全身炎症和毒性,仍然是有效免疫治疗的核心挑战。
在本研究中,通过基于多种饱和及不饱和脂肪酸的结构衍生,研究团队开发了小分子构建的纳米自组装体(mtDSN)。在细胞实验中,我们意外地发现该种小分子组装体能特异性地靶向线粒体,并高效诱导肿瘤细胞死亡(图1)。
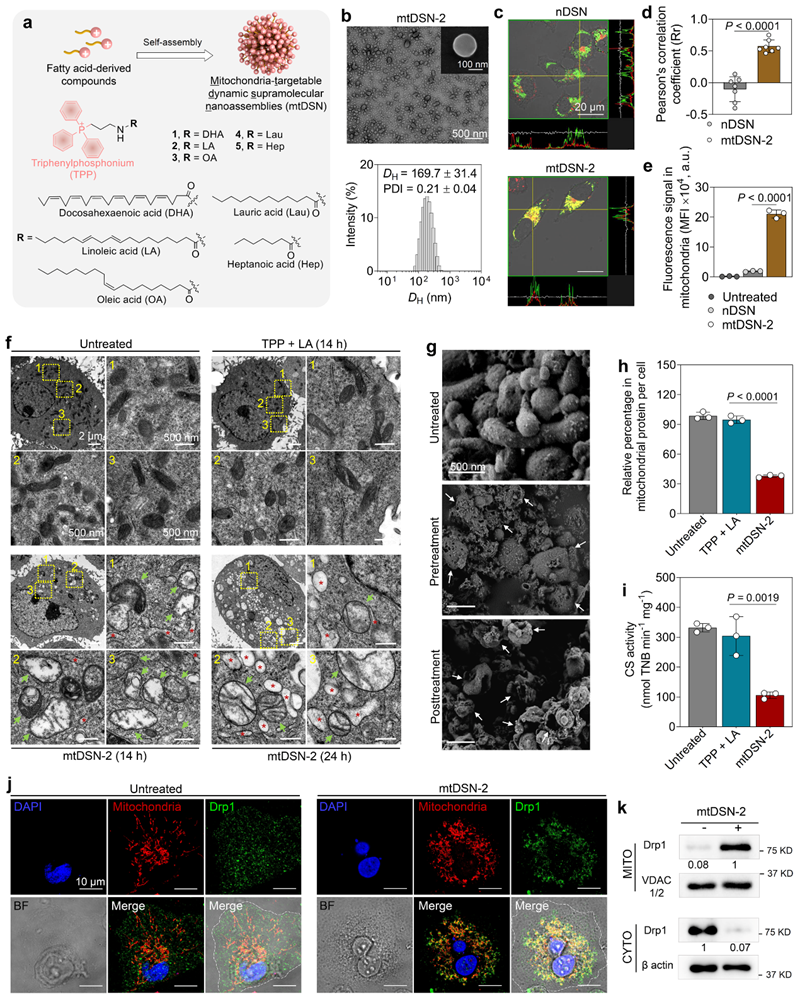
图1. 线粒体靶向的无药物小分子纳米自组装体(mtDSN)诱导线粒体功能障碍。
进一步,研究团队发现这一类全新的以往未被报道的“非药物”小分子自组装体,其细胞杀伤机制与传统化疗药物有显著区别。其通过聚集诱导的线粒体膜靶向损伤,启动内质网应激,并导致类凋/凋亡相关的免疫原性细胞死亡(图2)。
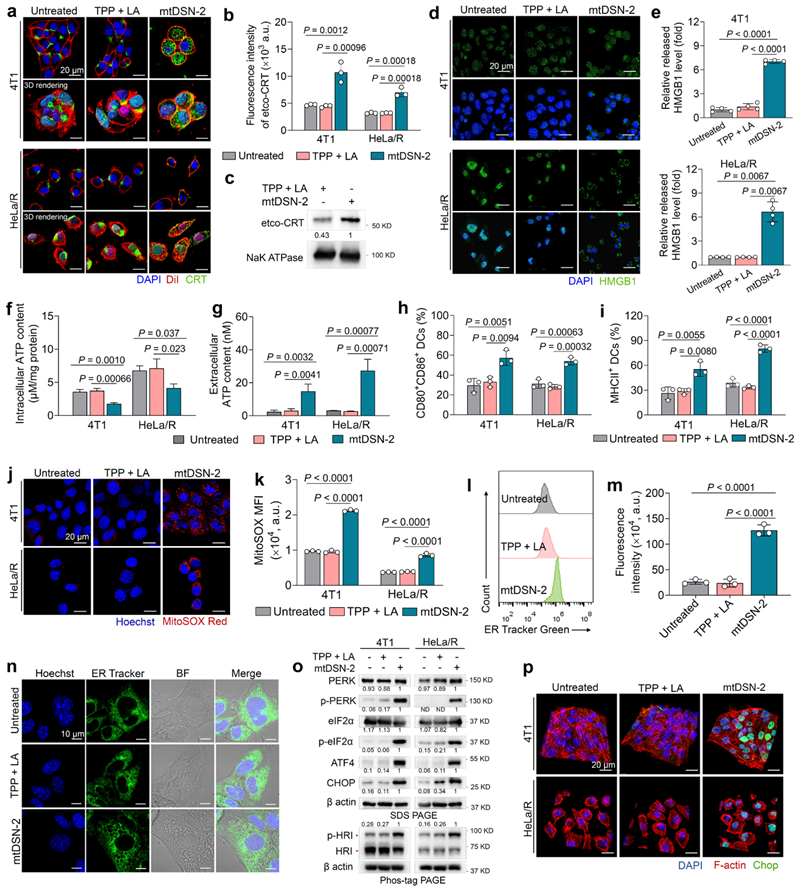
图2. mtDSN-2诱导肿瘤细胞应激相关的ICD级联从而促进树突状细胞成熟。
经过mtDSN处理,应激和垂死的肿瘤细胞可以作为预防性或治疗性肿瘤疫苗。在对PD-1阻断具有内在或获得性抵抗的小鼠荷瘤模型中,局部mtDSN给药可改善肿瘤免疫抑制微环境,实现“冷肿瘤”(低免疫原性、T 细胞低浸润活化)向“热肿瘤”(高免疫原性、T 细胞高浸润活化)的转变,并与ICB治疗协同作用,产生高效的抗肿瘤免疫应答(图3)。这种经化学结构优化的小分子纳米免疫增强剂的作用机制与已有的细胞毒类化疗药不同,为调控肿瘤免疫微环境提供了一种新的研究思路和策略。
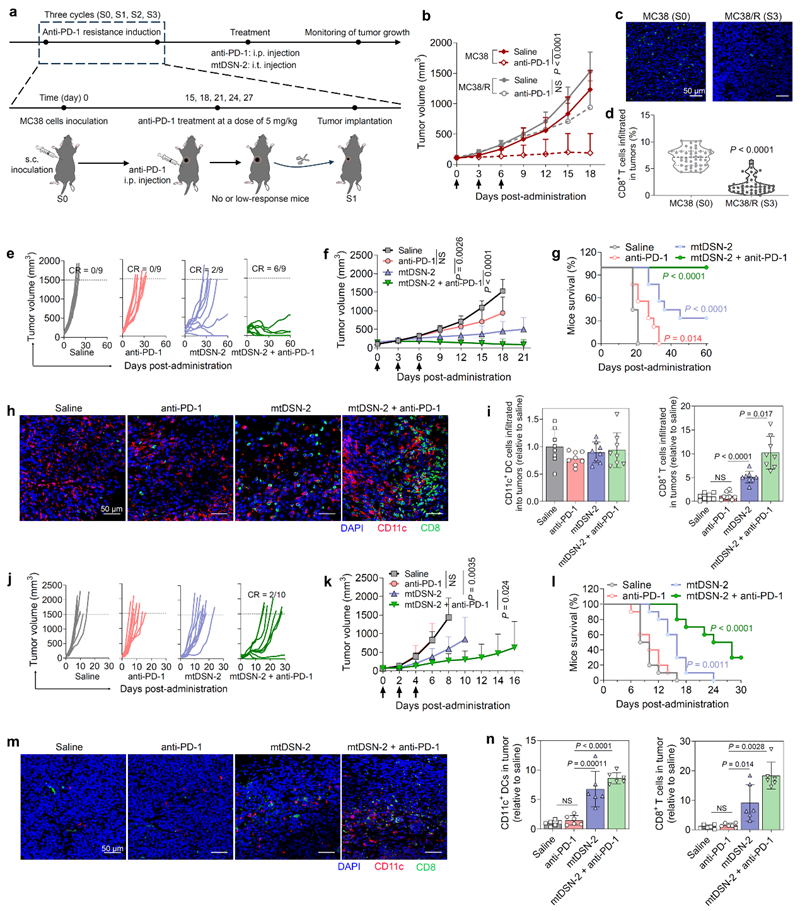
图3. mtDSN-2激活肿瘤免疫微环境,增强ICB在PD-1耐药肿瘤中的抗肿瘤免疫反应。
王杭祥教授课题组长期在抗肿瘤免疫药物和纳米递送系统的设计和转化应用领域开展深入研究,已在PNAS、Nat. Commun.、Cancer Res.、Adv. Mater.、ACS Nano、Biomaterials、J. Controlled Release等学术期刊发表论文100多篇,部分创新药成果已转让,并进入临床转化阶段。本研究获得了济南微生态生物医学省实验室项目(编号:JNL-2022010B)、山东省自然科学基金重大基础研究项目及国家自然科学基金委面上项目等经费的资助。