济南实验室顾晓松院士、江春平教授及吴俊华教授团队在《Cell Reports Medicine》上发表重要研究成果
2024年10月1日,济南实验室顾晓松院士、实验室副主任江春平教授及PI吴俊华教授团队以“Thymosin a1 reverses oncolytic adenovirus-induced M2 polarization of macrophages to improve antitumor immunity and therapeutic efficacy”为题在《Cell Reports Medicine》(IF:11.69,中科院一区)杂志发表重要研究成果。团队报道了胸腺肽 a1 通过逆转溶瘤腺病毒诱导的免疫负反馈——巨噬细胞 M2 极化和调节性 T 细胞 (Tregs) 的扩增,从而提高抗肿瘤免疫反应和治疗效果的相关成果。

溶瘤病毒(Oncolytic Virus, Ovs) 是一类新型的免疫治疗剂,可以通过优先在肿瘤细胞中复制、诱导免疫原性细胞死亡和刺激宿主抗肿瘤免疫来促进肿瘤消退。腺病毒是研究最广泛和最有前途的 OVs 之一,目前正在进行大量腺病毒的临床试验。
然而,由于腺病毒本身的一些潜在局限性,溶瘤腺病毒通常产生的抗肿瘤功效有限,其中之一就是免疫抑制反馈回路的诱导。目前为止,腺病毒诱导免疫抑制反馈回路以及补偿这些缺陷的治疗策略仍然研究不足。经过基因组改造的复制型V 型腺病毒(type V adenovirus,ADV)在治疗中可诱导巨噬细胞极化为“M2 样”的促肿瘤表型,并导致调节性 T 细胞 (Tregs) 的扩增。
胸腺肽 α 1 (Tα1) 是一种胸腺来源的免疫调节肽,被广泛认为可以调节先天免疫细胞的免疫活性,例如多形核白细胞、树突状细胞 (DC) 和巨噬细胞,其作为一种治疗性免疫调节剂,用于感染、恶性疾病和“胞葬”巨噬细胞极化的辅助治疗。 最近的一项研究表明,Tα1 通过激活 TLR7/SHIP1 轴来逆转胞吞作用诱导的巨噬细胞 M2 极化,从而提高化疗的疗效。
基于先前研究中肿瘤相关巨噬细胞 (TAM) 向 M2 表型的转化、ADV 治疗后肿瘤微环境 (TME) 内 Tregs 免疫浸润增加以及 Tα1 调节免疫细胞的能力的发现,该团队证实了 Tα1 可以通过逆转 ADV 诱导的免疫抑制细胞扩增来增强抗肿瘤功效。此外,他们还设计了一种表达 Tα1 的重组溶瘤腺病毒 (ADVTα1),与复制型V型腺病毒(ADV)和胸腺肽α1(Tα1)联合治疗肿瘤相比,它具有优越的免疫调节作用和抗肿瘤疗效,具有良好的临床应用潜力。
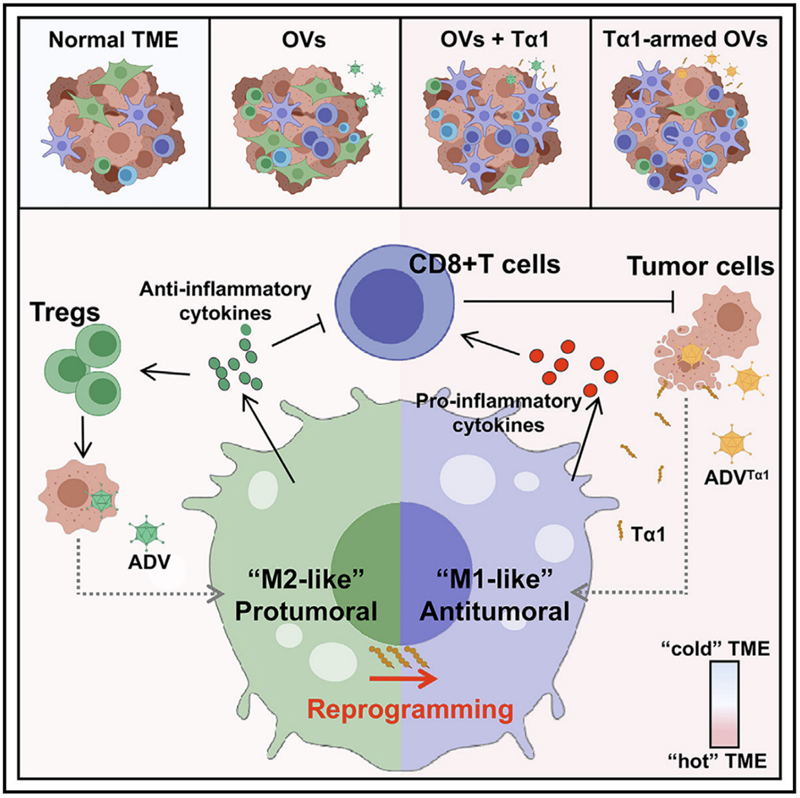
免疫抑制的主要参与者是 Tregs、“M2 样”TAM 和先天性肿瘤相关的抑制性髓样细胞。由ADV 诱导的免疫抑制反馈回路会降低抗肿瘤免疫力。更具体地说,ADV 感染的肿瘤细胞刺激巨噬细胞向“M2 样”促肿瘤表型极化,导致 Tregs 在 TME 内扩增。
肿瘤微环境(TME) 中的 TAM 大致可分为两组,即经典激活的“M1 样”抗肿瘤巨噬细胞和选择性激活的“M2 样”促瘤巨噬细胞。经典的“M1 样”极化被定义为 CD80、CD86、MHCII 和 iNOS 的表达,这与 TAM 的杀瘤功能有关。“M1样”肿瘤相关巨噬细胞可以吞噬癌细胞并产生促炎细胞因子以激活 CD8+ T 细胞以协调抗肿瘤免疫。相比之下,“M2 样”肿瘤相关巨噬细胞的特征是 CD206、VEGF、CD163、Arg-1 和 IL-10 的高表达,并募集 Tregs 以抑制抗肿瘤免疫。
此外,已发现 IL-10+TAM 与免疫抑制性 TME 相关,其中 IL-10+ TAM 导致细胞毒性 CD8+ T 细胞功能障碍并促进免疫逃避。这项研究发现,在体外,ADV 感染的肿瘤细胞与巨噬细胞直接接触导致巨噬细胞中 IL-10 的高表达。
在本研究中,Tα1 将“M2 样”促肿瘤巨噬细胞重编程为“M1 样”抗肿瘤巨噬细胞,并减少 ADV 治疗期间 TME 中的 Treg 浸润。此外,与多种实体瘤相比,联合疗法显示出卓越的抗肿瘤作用。
基于 ADV 和 Tα1 联合治疗的卓越抗肿瘤疗效,所构建的表达 Tα1 的重组溶瘤腺病毒,可以有效地将 TME 重编程为更有利于抗肿瘤免疫的状态。Tα1 已在超过 35 个国家被批准用于治疗慢性乙型肝炎和丙型肝炎。 由于Tα1 可以诱导抗病毒免疫反应,因而不推荐用于溶瘤腺病毒治疗,出人意料的是本研究中没有发现 Tα1 影响 ADVTa1 的溶瘤能力和复制能力。
综上所述,ADV 感染的肿瘤细胞以细胞接触依赖性方式诱导巨噬细胞采用“M2 样”促肿瘤表型,Tα1 的介入可以有效协调巨噬细胞重编程,从而增强 T 细胞介导的抗肿瘤反应。
科研启发
研究团队结果表明,与单药治疗相比,ADV与Tα1联合治疗在多种实体瘤中均表现出优越的抗肿瘤作用,并在H22荷瘤小鼠中导致肿瘤完全消除和长期免疫记忆。基于研究结果构建的表达Ta1重组腺病毒,可以有效地将TME重编程为更有利于抗肿瘤免疫的状态,其抗肿瘤功效不亚于联合治疗,同时给药负担更轻。该研究为溶瘤病毒组合治疗策略和溶瘤工程病毒的设计提供了灵感。
该研究得到了山东省实验室项目(编号SYS202202)、国家自然科学基金(编号81972888, 82272819)、和济南微生态生物医学省实验室科研项目(编号JNL2022004A, JNL2022019B, JNL2022017D)的资助。
原文链接:https://doi.org/10.1016/j.xcrm.2024.101751