济南实验室曹毅教授团队在《Cell Stem Cell》期刊发表重要成果
2024年10月21日,济南实验室PI曹毅教授、全职助理研究员杨佳鹏团队在《Cell Stem Cell》(IF:19.8)期刊发表了一篇题为“Photo-Tunable Hydrogels Reveal Cellular Sensing of Rapid Rigidity Changes through Accumulation of Mechanical Signaling Molecules”的研究型文章。研究团队利用具备光响应刚性的水凝胶,揭示了细胞在循环动态力学环境中对刚度变化的反应具有频率依赖性。引人注目的是,在某些频率下,细胞的牵引力甚至超过了在4倍硬度的静态基底上的牵引力,这挑战了现有的分子离合器模型。研究发现,牵引力的快速适应性与力传导信号蛋白缓慢失活之间的差异,导致了信号蛋白的积累,从而增强了细胞在动态环境下的长程牵引力。基于此,研究团队提出了一个融合了即时力传递和扩展信号的新模型,揭示了细胞通过信号蛋白的积累来感知细胞外基质刚度的周期性变化,进而增强其牵引力。这项研究强调了动态刚性在合成生物材料开发中的关键作用,突出了同时考虑即时和长期细胞反应的必要性。

在组织中,细胞处于由其他细胞和细胞外基质(ECM)构成的动态微环境中。它们通过黏着斑(FAs)与微环境进行机械互动,不仅能够施加牵引力,还能感知外部微环境的力学变化。通常,细胞的力感应是在静态环境下研究的,例如在软性材料上,细胞会产生较弱的牵引力。
然而,微环境的力学性质会随时间发生变化,特别是在组织发育或疾病过程中。即便是日常活动如心跳、呼吸和消化,也会带来周期性的机械波动,而这些波动对细胞功能至关重要。尽管分子离合器模型(molecular clutch model)有效地解释了细胞如何在较硬的基质上施加更多的力,但其在解释组织和器官中的动态机械波动适应性方面仍存在局限。
基于目前的研究局限,本研究开发了一种光响应水凝胶,能够快速且可逆地在硬态和软态之间切换。研究表明,快速周期性改变基底硬度(1分钟间隔、硬度变化28%)能够增强细胞的牵引力,甚至超过在4倍硬度但静态表面上的牵引力。
进一步研究发现,这种增强与细胞内黏着斑激酶(FAK)等信号蛋白的磷酸化有关,这些力信号蛋白在细胞外基质刚度快速变化后能够持续激活并积累,增强细胞牵引力。研究还建立了一个计算模型,解释了细胞如何整合动态机械信号来调节其行为和命运。
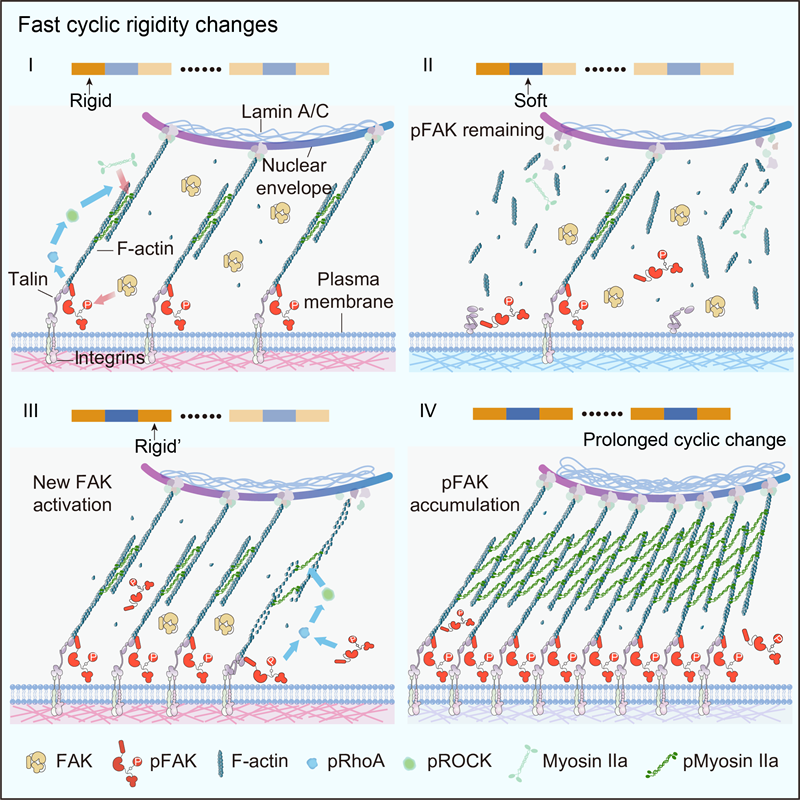
研究团队通过制备的新型光响应水凝胶(PYP水凝胶)探究了快速刚度变化对细胞力感应和信号传导的影响。结果显示,快速的基质刚度变化显著增强了细胞的牵引力,并促进了力信号的传导。进一步分析表明,当基质软化时,分子离合器解离,导致信号分子(如pFAK)从分子离合器或整合素簇中脱离并进入细胞质。
值得注意的是,脱离的力信号分子不会立即去磷酸化,仍保持力信号转导效应。当基质迅速恢复刚度时,这些磷酸化状态的信号分子会重新附着到重新组装的分子离合器上,导致力信号分子的积累,从而进一步增强细胞的牵引力。pFAK在软化阶段缓慢的去磷酸化速率和刚度恢复阶段快速的磷酸化速率,是增强力信号转导的关键因素。
这项研究表明,细胞力信号传导是一个跨越多个时间尺度的复杂过程,力传递通常在秒到分钟内发生,而信号分子的磷酸化和去磷酸化则较为缓慢。
科研启发
在未来研究中,团队将深入探讨这些时间尺度的相互作用,以进一步理解细胞如何将动态力信号转化为具体的生物学结果。这一发现对于活性生物材料设计和组织工程应用具有重要意义。
济南微生态生物医学省实验室为该论文第一完成单位,济南微生态生物医学省实验室助理研究员杨佳鹏为第一作者,济南微生态生物医学省实验室PI曹毅教授等为共同通讯作者。该研究得到了国家重点研发计划(编号2020YFA0908100)、国家自然科学基金(编号T2222020, T2225016和11934008)、山东省实验室项目(编号SYS202202)、济南微生态生物医学省实验室科研项目(编号JNL2022019B和JNL2023004Q)和江苏省自然科学基金(编号BK20220120)的资助。
原文链接:https://doi.org/10.1016/j.stem.2024.09.016