王杭祥教授团队受邀在《Trends in Immunology》阐述STING蛋白调控的抗肿瘤免疫新策略
近日,针对传统激活干扰素基因刺激蛋白(STING)激动剂临床应用受限(如需瘤内注射、系统给药毒副作用大)这一关键瓶颈,王杭祥教授团队受邀在顶尖免疫学期刊《Trends in Immunology》发表了题为“Repurposing of old drugs for unleashing innate immunity”的Spotlight评述论文。评述论文深入剖析了一项利用“老药”卡维地洛(Carvedilol)变构增敏STING通路的突破性研究。该研究发现一种上市多年的老药—卡维地洛,能够通过一种全新的信号蛋白通路增敏的调控方式来激活抗肿瘤免疫,有望解决靶向STING通路的抗肿瘤药物的耐药性。

激活干扰素基因刺激蛋白(STING)通路是极具前景的抗肿瘤免疫的治疗策略。STING通路作为固有免疫系统的核心通路,能够有效激活人体的免疫系统来攻击癌细胞,从而将缺乏免疫细胞浸润的“冷肿瘤”转变为免疫细胞大量浸润的“热肿瘤”。然而,传统的STING激动剂在临床使用中需要瘤内注射,临床应用受限。而系统给药面临全身性免疫副作用、药物递送困难和药代动力学较差等重大挑战。这导致目前全球尚无一款STING激动剂获批上市,开发安全有效的STING药物具有重要的临床价值。
该Spotlight论文重点剖析了Dang等人发表于《Cell reports》的一项最新研究。该研究通过大规模高通量筛选发现,一种已在临床安全使用多年的心血管药物—卡维地洛(Carvedilol),能够以一种新的模式调控STING通路(图1)。卡维地洛与原有的STING激动剂的作用方式不同,其只是扮演了一个信号通路放大的作用。卡维地洛不直接激活STING通路,而是结合到STING蛋白上的变构位点(T263)。此外,卡维地洛仅在肿瘤细胞释放内源性激活信号(如cGAMP)时,才选择性地、高效地放大STING激活作用。这种条件性的激活模式,使其能够精准作用于肿瘤微环境,从而有望规避传统激动剂引发的炎症因子风暴等毒副作用。
此外,该Spotlight文章深入阐述这一新治疗策略在体内产生抗肿瘤效应的关键机制。抗肿瘤药效的产生并不依赖于传统的CD8+ T细胞,而是通过强力激活和招募固有免疫系统的第一道防线—自然杀伤细胞来清除肿瘤。这一发现具有较大的临床意义,可为缺乏T细胞浸润、对现有免疫检查点抑制剂无应答的“冷肿瘤”提供有效的治疗可能性。
该研究为STING靶向药物开发提供了新的思路和方案—从广谱的激活转向精准的调控。卡维地洛作为安全性已知的上市药物,其“老药新用”的策略为快速临床转化提供较大的可行性,同时也为设计更安全高效的变构免疫调节剂提供新方案。
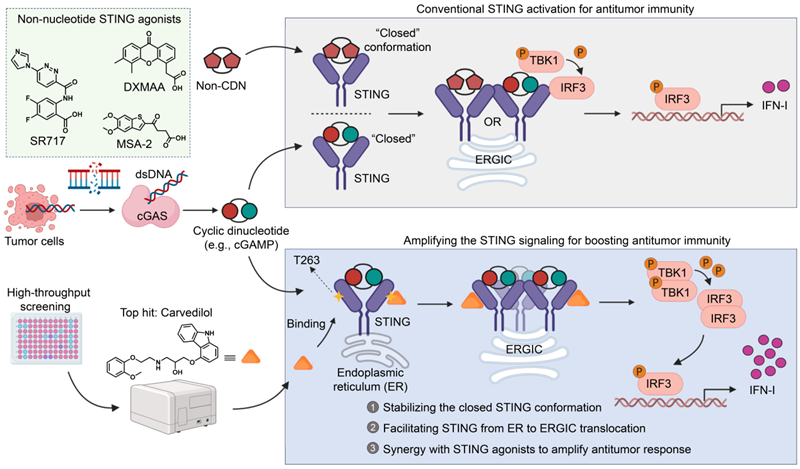
图1,卡维地洛:一种新型STING通路信号增敏药物。Dang等人的研究突破了传统STING激动剂的工作模式。常规的STING激活方式(上图)依赖于配体,如环状二核苷酸(例如cGAMP)或合成的类环状二核苷酸化合物(例如DXMAA, MSA-2或SR717等),通过结合到正构位点来触发下游信号传导和I型干扰素的产生。而Dang等人的研究表明,卡维地洛是作为一种变构调节剂发挥作用的(下图)。该化合物结合于T263氨基酸残基,这一作用能够稳定活性的STING构象,促进其从内质网到内质网-高尔基体中间体室的转运,并协同性地放大由初始信号所启动的I型干扰素应答。缩写:cGAMP, 环磷酸鸟苷-腺苷;cGAS, 环磷酸鸟苷-腺苷合酶;dsDNA, 双链DNA;ER, 内质网;ERGIC, 内质网-高尔基体中间体室;IFN-I, I型干扰素;IRF3, 干扰素调节因子3;STING, 干扰素基因刺激蛋白;TBK1, TANK结合激酶1。
评述核心观点:卡维地洛作为一种安全已知的上市药物,通过独特的“变构增敏”机制,仅在肿瘤微环境存在内源信号时选择性放大STING激活,为开发安全、有效的系统性STING靶向疗法提供了极具转化前景的全新思路。
王杭祥课题组长期从事抗肿瘤免疫药物和递送系统的基础和临床转化研究。近年在STING激动剂相关药物制剂研究领域取得了一些成果,在Cancer Res.、Nat. Commun.等期刊发表多篇论文。该团队已在PNAS、Nat. Commun.、Cancer Res.、Adv. Mater.、ACS Nano、Biomaterials、J. Controlled Release等学术期刊发表论文100多篇。本研究工作得到了山东省自然科学基金(ZR2023ZD59)及济南微生态生物医学省实验室科研项目(JNL-2025007B)等的资助。