李新钢教授团队、张迪研究员团队在低氧胶质瘤来源外泌体miR-423-3p诱导星形胶质细胞活化的机制研究领域取得新进展
近日,实验室副主任李新钢教授团队及PI张迪研究员团队探讨了胶质瘤通过外泌体对于星形胶质细胞的作用及其具体机制,以及探讨了低氧和常氧情况下的胶质瘤细胞对星形胶质细胞的激活作用差异。该研究在《 Cell Death & Disease》杂志以题为“Inhibition of hypoxic exosomal miR-423-3p decreases glioma progression by restricting autophagy in astrocytes”的研究成果。

胶质瘤作为中枢神经系统的主要原发肿瘤,病人的预后多较差。当前胶质瘤治疗方案采用以手术切除为基础,结合放疗、化疗、分子靶向干预等多模式综合治疗策略。然而,受限于肿瘤细胞的耐药性、侵袭性生长特性等方面,现有疗法在控制肿瘤进展和预防复发方面仍存在明显不足。
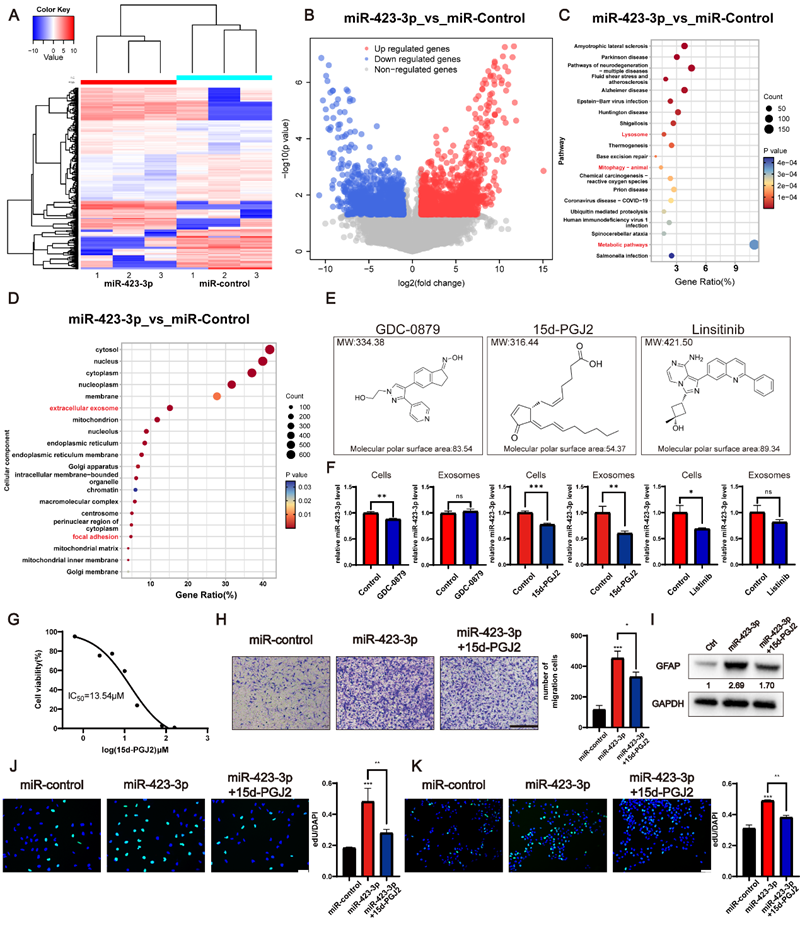
该研究提取了低氧和常氧条件下的胶质瘤细胞外泌体,并以此处理星形胶质细胞,随后使用transwell、edU、ELISA等方法探讨了活化星形胶质细胞的表型以及活化标志物差异,并使用Western blot、透射电镜等方式验证了活化星形胶质细胞的自噬水平差异,同时使用miRNA阵列探寻了胶质瘤外泌体中诱导星形胶质细胞活化的关键分子。使用转录组测序获得活化星形胶质细胞的差异表达基因,并使用cMAP数据库预测了抑制星形胶质细胞的潜在药物。
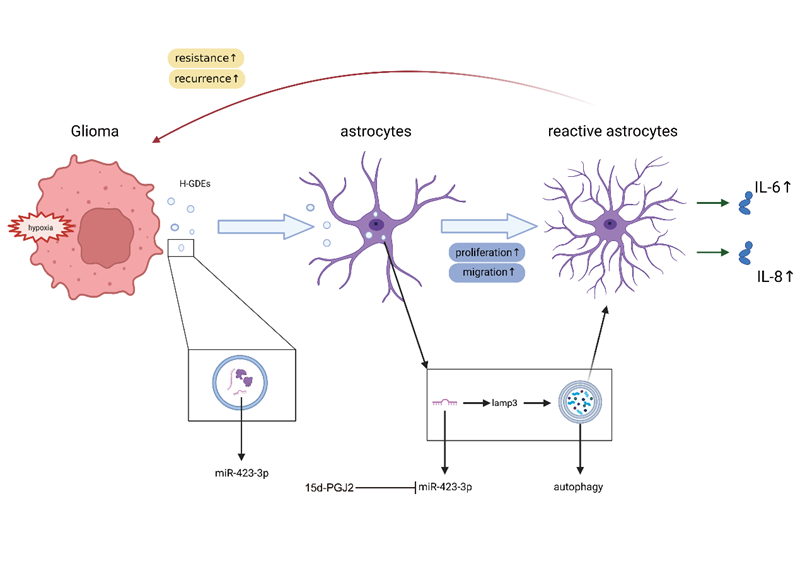
与常氧胶质瘤外泌体相比,低氧胶质瘤外泌体展现出更强的促星形胶质细胞活化效应,且其机制与细胞自噬过程密切相关。低氧外泌体中miR-423-3p表达水平显著高于常氧组,该microRNA被证实通过激活自噬介导星形胶质细胞的活化。同时,机制研究表明,15d-PGJ2可通过拮抗miR-423-3p的生物活性,有效抑制此类胶质细胞活化过程,揭示了潜在的治疗干预靶点。
科研启发
该研究验证了胶质瘤微环境中的存在的正反馈环路,即低氧胶质瘤外泌体诱导星形胶质细胞活化,活化的星形胶质细胞则可以进一步促进胶质瘤的进展。探讨了胶质瘤肿瘤微环境的具体运作机制,并提出了15d-PGJ2作为潜在胶质瘤治疗药物的可能性,为临床胶质瘤治疗提供了新的思路。
该研究得到了国家自然科学基金资助项目(82071512、82203760、81701329、82102960)、山东省自然科学基金项目(ZR2019ZD33)、山东省实验室项目(SYS202202)、济南微生态生物医学省实验室科研项目(JNL-2022003A)的资助